 Реакции, которые называют окислительно-восстановительными (ОВР), происходят с изменением степеней окисления атомов, находящихся в составе молекул реагентов. Эти изменения происходят в связи с переходом электронов от атомов одного элемента к другому.
Реакции, которые называют окислительно-восстановительными (ОВР), происходят с изменением степеней окисления атомов, находящихся в составе молекул реагентов. Эти изменения происходят в связи с переходом электронов от атомов одного элемента к другому.
Процессы, протекающие в природе и осуществляемые человеком, в большинстве своём представляют ОВР. Такие важнейшие процессы, как дыхание, обмен веществ, фотосинтез (6CO2+H2O = C6H12O6 + 6O2), — всё это ОВР.
В промышленности с помощью ОВР получают аммиак, серную, соляную кислоты и многое другое.
Восстановление металлов из руд — фактически основа всей металлургической промышленности — тоже окислительно-восстановительные процессы. Например, реакция получения железа из гематита: 2Fe2O3 + 3С = 4Fe+3CO2.
Окислители и восстановители: характеристика
 Атомы, которые в процессе химического превращения электроны отдают, называются восстановителями, их степень окисления (СО) в результате увеличивается. Атомы, принимающие электроны, называют окислителями, и их СО уменьшается.
Атомы, которые в процессе химического превращения электроны отдают, называются восстановителями, их степень окисления (СО) в результате увеличивается. Атомы, принимающие электроны, называют окислителями, и их СО уменьшается.
Говорят, что окислители, принимая электроны, восстанавливаются, а восстановители — окисляются в процессе отдачи электронов.
Важнейшие представители окислителей и восстановителей представлены в следующей таблице:
| Типичные окислители | Типичные восстановители |
| Простые вещества, состоящие из элементов с высокой электроотрицательностью (неметаллы): йод, фтор, хлор, бром, кислород, озон, сера и т. п. | Простые вещества, состоящие из атомов элементов с низкой электроотрицательностью (металлы или неметаллы): водород H2, углерод C (графит), цинк Zn, алюминий Al, кальций Ca, барий Ba, железо Fe, хром Cr и так далее. |
Молекулы или ионы, содержащие в составе атомы металлов или неметаллов с высокими степенями окисления:
| Молекулы или ионы, имеющие в своём составе атомы металлов или неметаллов с низкими степенями окисления:
|
| Ионные соединения, содержащие катионы некоторых металлов с высокими СО: Pb3+, Au3+, Ag+, Fe3+ и другие. | Органические соединения: спирты, кислоты, альдегиды, сахара. |
 На основе периодического закона химических элементов чаще всего можно предположить окислительно-восстановительные способности атомов того или иного элемента. По уравнению реакции также несложно понять, какие из атомов являются окислителем и восстановителем.
На основе периодического закона химических элементов чаще всего можно предположить окислительно-восстановительные способности атомов того или иного элемента. По уравнению реакции также несложно понять, какие из атомов являются окислителем и восстановителем.
Как определить, является атом окислителем или восстановителем: достаточно записать СО и понять, какие атомы её увеличили впроцессе реакции (восстановители), а какие уменьшили (окислители).
Вещества с двойственной природой
 Атомы, имеющие промежуточные СО, способны и принимать и отдавать электроны, в результате этого вещества, содержащие в своём составе такие атомы, будут иметь возможность проявить себя как окислителем, так и восстановителем.
Атомы, имеющие промежуточные СО, способны и принимать и отдавать электроны, в результате этого вещества, содержащие в своём составе такие атомы, будут иметь возможность проявить себя как окислителем, так и восстановителем.
Примером может быть пероксид водорода. Содержащийся в его составе кислород в СО -1 может как принять электрон, так и отдать его.
При взаимодействии с восстановителем пероксид проявляет окислительные свойства, а с окислителем — восстановительные.
Рассмотреть подробнее можно при помощи следующих примеров:
- восстановление (пероксид выступает как окислитель) при взаимодействии с восстановителем,
SO2 + H2O2 = H2SO4
О-1 +1е = О-2
- окисление (пероксид является в этом случае восстановителем) при взаимодействии с окислителем.
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5О2 + K2SO4 + 8H2O
2О-1 -2е = О20
Классификация ОВР: примеры
Различают следующие типы окислительно-восстановительных реакций:
- межмолекулярное окисление-восстановление (окислитель и восстановитель находятся в составе разных молекул),
- внутримолекулярное окисление-восстановление (окислитель находится в составе той же молекулы, что и восстановитель),
- диспропорционирование (окислителем и восстановителем является атом одного и того же элемента),
- репропорционирование (окислитель и восстановитель образуют в результате реакции один продукт).
Примеры химических превращений, относящихся к различным типам ОВР:
- Внутримолекулярные ОВР — это чаще всего реакции термического разложения вещества:
2KCLO3 = 2KCl + 3O2
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
2NaNO3 = 2NaNO2 + O2
- Межмолекулярные ОВР:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
2Al + Fe2O3 = Al2O3 + 2Fe
N2 + 3H2 = 2NH3
- Реакции диспропорционирования:
3Br2 + 6KOH = 5KBr + KBrO3 + 6H2O
3HNO2 = HNO3 + 2NO + H2O
2NO2 + H2O = HNO3 + HNO2
4KClO3 = KCl + 3KClO4
- Реакции репропорционирования:
2H2S + SO2 = 3S + 2H2O
HOCl + HCl = H2O + Cl2
Токовые и бестоковые ОВР
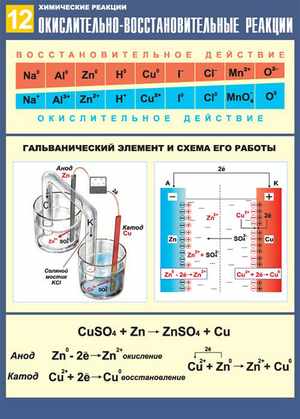
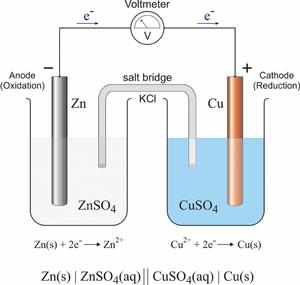
 Окислительно-восстановительные реакции также разделяют на токовые и бестоковые.
Окислительно-восстановительные реакции также разделяют на токовые и бестоковые.
Первый случай — это получение электрической энергии за счёт химической реакции (такие источники энергии могут использоваться в двигателях машин, в радиотехнических устройствах, приборах управления), либо электролиз, то есть химическая реакция, наоборот, возникает за счёт электроэнергии (с помощью электролиза можно получать различные вещества, обрабатывать поверхности металлов и изделий из них).
Примерами бестоковых ОВР можно назвать процессы горения, коррозии металлов, дыхания и фотосинтеза и т.д.
Метод электронного баланса ОВР в химии
 Уравнения большинства химических реакций уравниваются несложным подбором стехиометрических коэффициентов. Однако при подборе коэффициентов для ОВР можно столкнуться с ситуацией, когда количество атомов одних элементов не удаётся уравнять, не нарушая при этом равенство количеств атомов других. В уравнениях таких реакций подбирают коэффициенты методом составления электронного баланса.
Уравнения большинства химических реакций уравниваются несложным подбором стехиометрических коэффициентов. Однако при подборе коэффициентов для ОВР можно столкнуться с ситуацией, когда количество атомов одних элементов не удаётся уравнять, не нарушая при этом равенство количеств атомов других. В уравнениях таких реакций подбирают коэффициенты методом составления электронного баланса.
Основывается метод на том, что сумма принимаемых окислителем электронов и количество отдаваемых восстановителем приводится к равновесию.
Метод складывается из нескольких этапов:
- Записывается уравнение реакции.
- Определяются СО элементов.
- Определяются элементы, которые в результате реакции изменили свои степени окисления. Отдельно записываются полуреакции окисления и восстановления.
- Подбираются множители для уравнений полуреакций так, чтобы уравнять принятые в полуреакции восстановления и отданные в полуреакции окисления электроны.
- Подобранные коэффициенты проставляются в уравнение реакции.
- Подбираются остальные коэффициенты реакции.
На простом примере взаимодействия алюминия с кислородом удобно написать уравнивание поэтапно:
- Уравнение: Al + O2 = Al2О3
- СО у атомов в простых веществах алюминия и кислорода равны 0.
Al0 + O20 = Al+32O-23
- Составим полуреакции:
Al0 -3е = Al+3,
O20 +4e = 2O-2
- Подбираем коэффициенты, при умножении на которые сравняется количество принятых и количество отданных электронов будет одинаковым:
Al0 -3е = Al+3 коэффициент 4,
O20 +4e = 2O-2 коэффициент 3.
- Проставляем коэффициенты в схему реакции:
4Al + 3O2 = Al2O3
- Видно, что для уравнивания всей реакции достаточно поставить коэффициент перед продуктом реакции:
4Al + 3O2 = 2Al2O3
Примеры заданий на составление электронного баланса
Могут встречаться следующие задания на уравнивания ОВР:
- Взаимодействие перманганата калия с хлоридом калия в кислой среде с выделением газообразного хлора.
 Марганцевокислый калий KMnO4 (перманганат калия, «марганцовка») — сильный окислитель за счёт того, что в KMnO4 степень окисления Mn равна +7. С его помощью часто получают газообразный хлор в лабораторных условиях по следующей реакции:
Марганцевокислый калий KMnO4 (перманганат калия, «марганцовка») — сильный окислитель за счёт того, что в KMnO4 степень окисления Mn равна +7. С его помощью часто получают газообразный хлор в лабораторных условиях по следующей реакции:
KCl + KMnO4 + H2SO4 = Cl2 + MnSO4 + K2SO4 + H2O
K+1Cl-1 + K+1Mn+7O4-2 + H2+1S+6O4-2 = Cl20 + Mn+2S+6O4-2 + K2+1S+6O4-2 + H2+1O-2
Электронный баланс:
Как видно после расстановки СО, атомы хлора отдают электроны, повышая свою СО до 0, а атомы марганца электроны принимают:
Mn+7 +5е = Mn+2 множитель два,
2Cl-1 -2е = Cl20 множитель пять.
Проставляем в уравнение коэффициенты в соответствии с подобранными множителями:
10K+1Cl-1 + 2K+1Mn+7O4-2 +H2SO4 = 5Cl20 + 2Mn+2S+6O4-2 + K2SO4 + H2O
Уравниваем количество остальных элементов:
10KCl + 2KMnO4 + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8H2O
- Взаимодействие меди (Cu) с концентрированной азотной кислотой(HNO3) с выделением газообразного оксида азота (NO2):
Cu + HNO3(конц.) = NO2 + Cu(NO3)2 + 2H2O
СО :
Cu0 + H+1N+5O3-2 = N+4O2 + Cu+2(N+5O3-2)2 + H2+1O-2
Электронный баланс :
Как видно, атомы меди повышают свою СО с нуля до двух, а атомы азота — снижают с +5 до +4
Cu0 -2е = Cu+2 множитель один,
N+5 +1е = N+4 множитель два.
Проставляем в уравнение коэффициенты:
Cu0 + 4H+1N+5O3-2 = 2N+4O2 + Cu+2(N+5O3-2)2 + H2+1O-2
Уравниваем остальные элементы:
Cu + 4HNO3(конц.) = 2NO2 + Cu (NO3)2 + 2H2O
- Взаимодействие дихромата калия с Н2S в кислой среде:
Запишем схему реакции, расставим СО:
К2+1Сr2+6О7-2 + Н2+1S-2 + Н2+1S+6O4-2 = S0 + Сr2+3(S+6O4-2)3 + K2+1S+6O4-2 + H2O
S-2 –2e = S0 коэффициент 3,
2Cr+6 +6e = 2Cr+3 коэффициент 1.
Подставляем:
К2Сr2О7 + 3Н2S + Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + Н2О
Уравниваем остальные элементы:
К2Сr2О7 + 3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + 7Н2О
Влияние реакционной среды
Характер среды влияет на протекание тех или иных ОВР. Роль реакционной среды можно проследить на примере взаимодействия перманганата калия (KMnO4) и сульфита натрия (Na2SO3) при различных значениях рН:
- Na2SO3 + KMnO4 = Na2SO4 + MnSO4 + K2SO4 (pH <,7 кислая среда),
- Na2SO3 + KMnO4 = Na2SO4 + MnO2 + KOH (pH =7 нейтральная среда),
- Na2SO3 + KMnO4 = Na2SO4 + K2MnO4 + H2O (pH >,7 щелочная среда).
Видно, что изменение кислотности среды приводит к образованию разных продуктов взаимодействия одних и тех же веществ. При изменении кислотности среды они происходят и для других реагентов, вступающих в ОВР. Аналогично показанным выше примерам реакции с участием дихромат-иона Cr2O72- будут проходить с образованием разных продуктов реакции в различных средах:
в кислой среде продуктом будет Cr3+,
в щелочной — CrO2, CrO33+,
в нейтральной — Cr2O3.